ИС "МДЛП" - Информационная система мониторинга движения лекарственных препаратов.
Подробно ознакомиться с материалами документации можно на сайте оператора системы маркировкиНормативно-правовое обеспечение ФГИС МДЛП
Федеральный закон от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств»;
Федеральный закон от 6 апреля 2011 г. N 63-ФЗ «Об электронной подписи»;
Федеральный закон от 15.04.2019 № 58-ФЗ «О внесении изменений в Кодекс Российской Федерации об административных правонарушениях» (начало действия документа 01.07.2020)
Постановление Правительства РФ от 30.06.2020 N 955 «Об особенностях ввода в гражданский оборот лекарственных препаратов для медицинского применения» (срок действия документа ограничен 1 января 2021 года);
Постановление Правительства РФ от 02.11.2020 № 1779 «О внесении изменений в Положение о системе мониторинга движения лекарственных препаратов для медицинского применения»;
Постановление Правительства РФ от 18.12.2020 № 2166 «О внесении изменений в Положение о системе мониторинга движения лекарственных препаратов для медицинского применения»;
Постановление Правительства РФ от 14.12.2018 № 1558 «Об утверждении правил размещения общедоступной информации, содержащейся в системе мониторинга движения лекарственных препаратов для медицинского применения, в информационно-телекоммуникационной сети “Интернет” (в том числе в форме открытых данных)»;
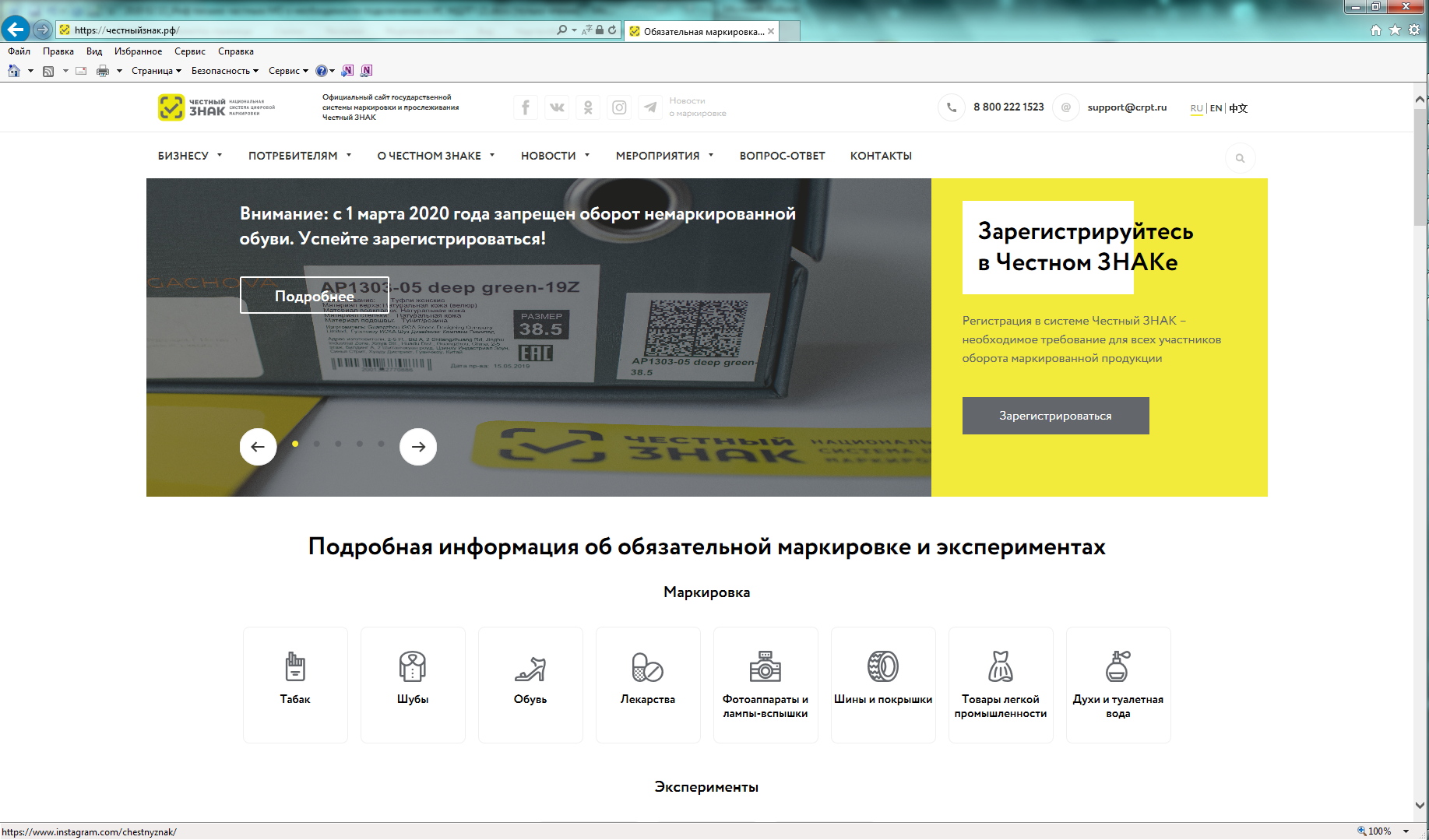
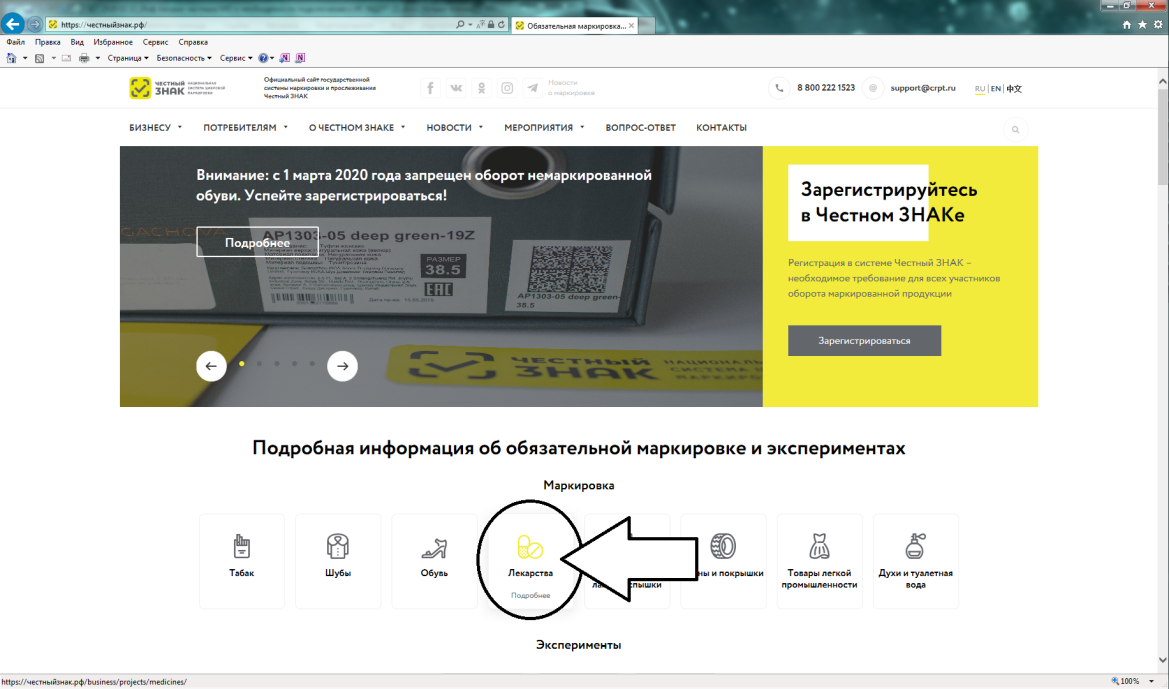
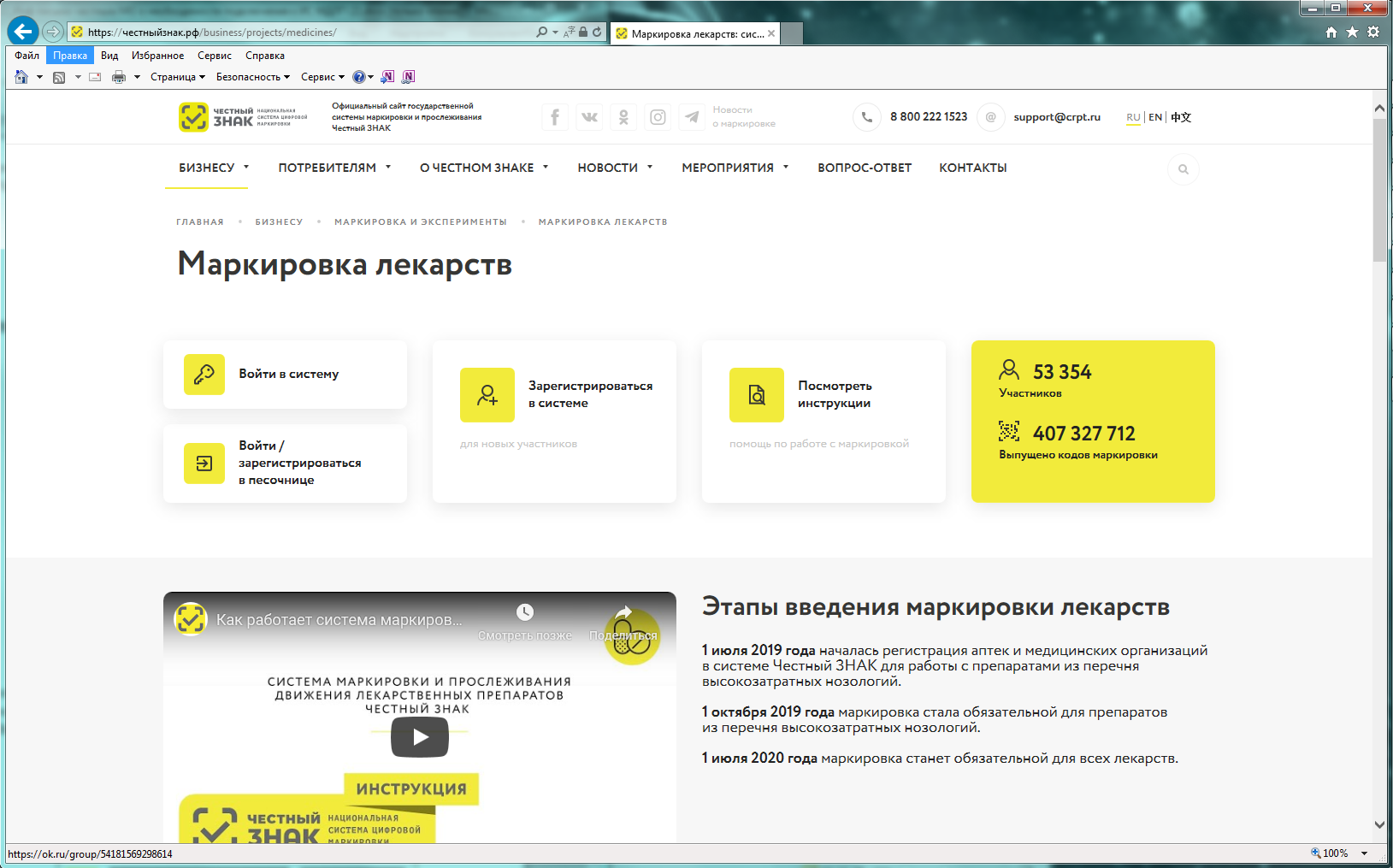
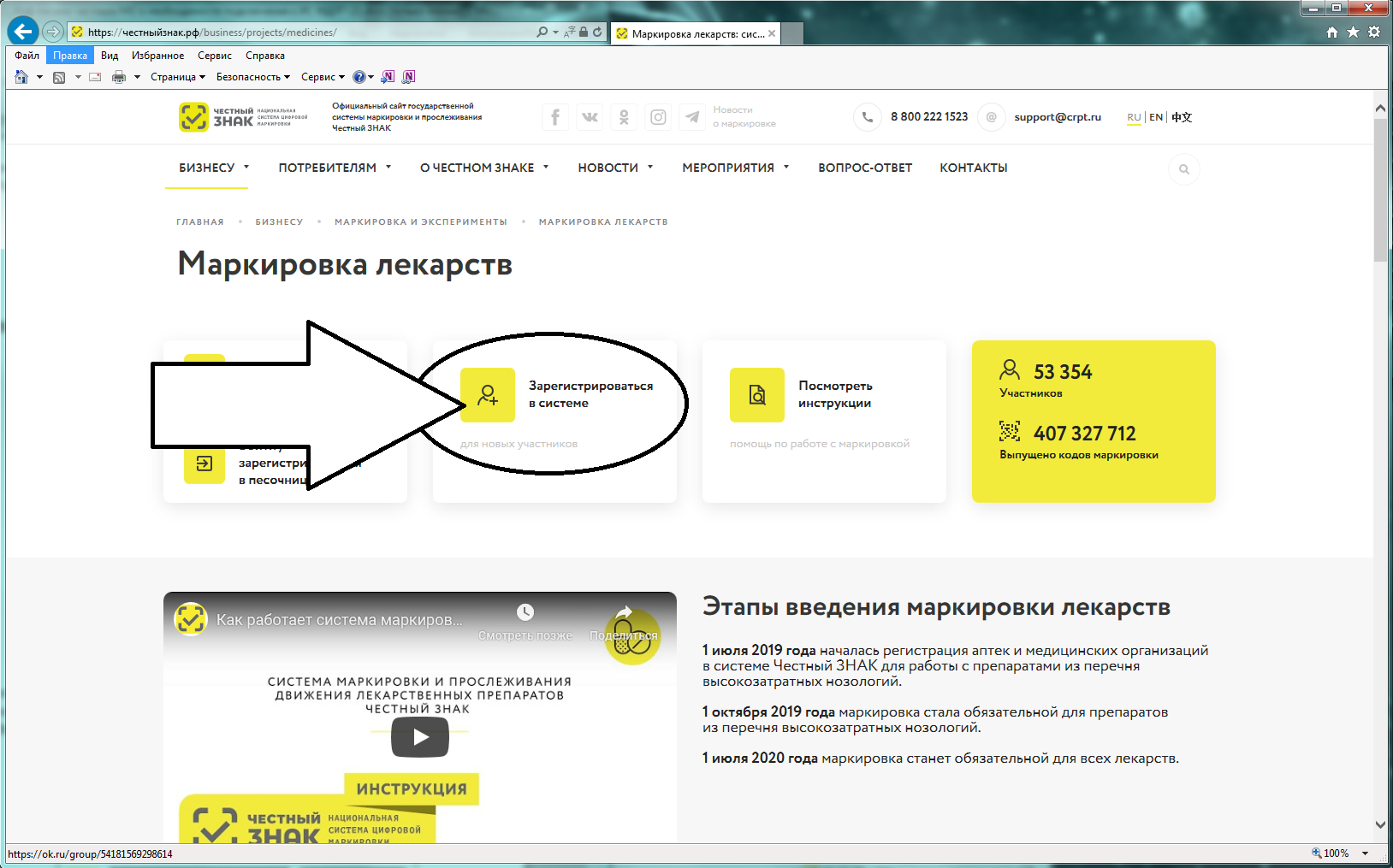
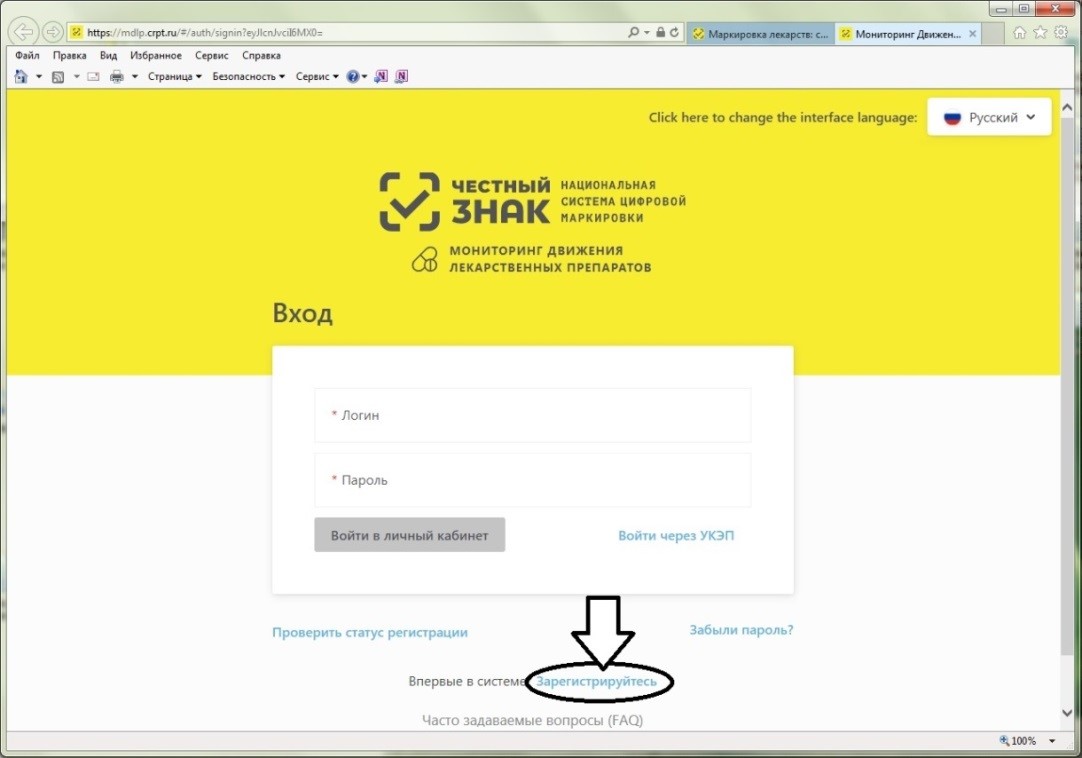
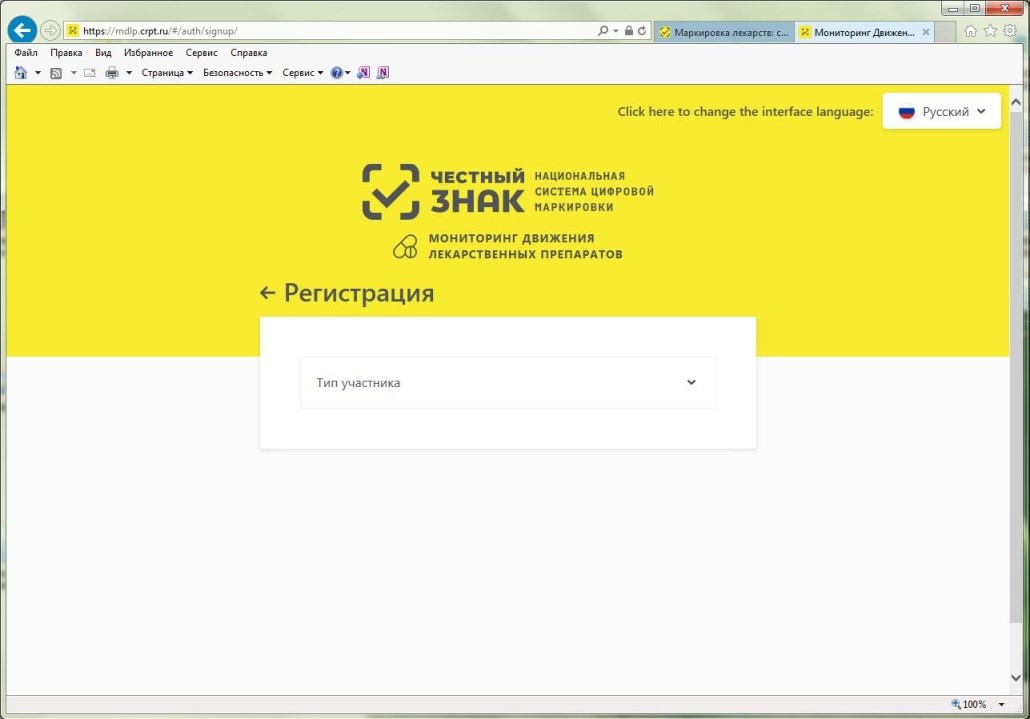
Порядок регистрации в информационной системе мониторинга движения лекарственных препаратов (ИС МДЛП) Регистрация в информационной системе мониторинга движения лекарственных препаратов (ИС МДЛП) Для успешной подготовки к регистрации организациям в ИС МДЛП необходимо убедиться в выполнении следующих условий: Регистрация организации с УКЭП, оформленной на сотрудника, отличного от руководителя, не предусмотрена. Если у вашей организации нет УКЭП, то ее можно оформить в одном из удостоверяющих центров, аккредитованных Министерством цифрового развития, связи и массовых коммуникаций Российской Федерации. Перечень аккредитованных удостоверяющих центров можно найти по адресу: https://minsvyaz.ru/ru/activity/govservices/2 Проверить сведения в ЕГРЮЛ/ЕГРИП и РАФП можно на сайте ФНС России. Проверить сведения о лицензиях можно: Важная информация Для регистрации в Личном кабинете участника ИС МДЛП, рекомендуется осуществить следующие действия: После перехода по данной ссылке, откроется портал национальной системы цифровой маркировки (см. рисунок 2). Далее надо перейти в раздел «Маркировка лекарств», с главной страницы портала цифровой маркировки это можно сделать, нажав на пиктограмму лекарств в блоке информации «Подробная информация об обязательной маркировке и экспериментах» – «Маркировка»(см. рисунок 3). Вы перейдете в раздел «Маркировка лекарств». На данной странице представлена информация от национальной системы цифровой маркировки «Честный знак» в части маркировки лекарственных препаратов (см. рисунок 4). Для регистрации в информационной системе мониторинга движения лекарственных препаратов (далее – ИС МДЛП) необходимо нажать на кнопку с пиктограммой пользователя с плюсом и надписью «Зарегистрироваться в системе». Если ваше интернет-соединение медленное, скорее всего вы увидите следующее изображение (см. рисунок 6) На странице входа в систему необходимо нажать на ссылку для регистрации в системе (см. рисунок 7). Откроется страница регистрации в системе (см. рисунок 8). После выбора типа участника, система запросит необходимое программное обеспечение (см. рисунок 9). Далее, при необходимости, следует установить программное обеспечение, сертификаты ключей электронной подписи и выполнить настройки программного обеспечения. Ниже представлены требования программного обеспечения в виде списка: Далее вам понадобится Руководство пользователя, откройте пункт 2 раздела 2.2.1 и следуйте дальнейшим инструкциям.Порядок регистрации в ИС МДЛП
Обновлено 13.02.2020

либо MasOS X 10 (или более поздние);
по адресу http://clsz.fsb.ru/certification.htm ;
Материалы по МДЛП по Всероссийскому совещанию в Москве 11.09.2019 г. доступны по ссылке: http://www.roszdravnadzor.ru/pages/about/conference/markirovka Локация: 28-29 октября 2019 года, Москва, ГК «Измайлово» На семинаре будут рассмотрены следующие вопросы: К УЧАСТИЮ В СЕМИНАРЕ ПРИГЛАШЕНЫ: УСЛОВИЯ УЧАСТИЯ В СЕМИНАРЕ: МЕСТО ПРОВЕДЕНИЯ СЕМИНАРА: УСЛОВИЯ БРОНИРОВАНИЯ ГОСТИНИЦЫ: СПРАВКИ И ОБЯЗАТЕЛЬНАЯ ПРЕДВАРИТЕЛЬНАЯ РЕГИСТРАЦИЯ СЛУШАТЕЛЕЙАрхив
Приглашение на практический семинар
Анкета для регистрации на семинар
ГОСУДАРСТВЕННЫЙ КОНТРОЛЬ ЛЕКАРСТВЕННЫХ СРЕДСТВ В 2020 ГОДУ. НОВАЯ СИСТЕМА МАРКИРОВКИ. РЕКОМЕНДАЦИИ РОСЗДРАВНАДЗОРА.
+7 (495) 792-98-98 (Звонок бесплатный)
ПО ТЕЛЕФОНУ: +7 (915) 449-80-90
ek5525721@yandex.ru
Новости / Архив новостей
14.04.2022
Национальная система цифровой маркировки подвергается массированным DDoS-атакам с 7 апреля. Оператор Центр развития перспективных технологий адаптировал систему к работе в условиях кибератак, она работает в штатном режиме.
В случае, если возникают индивидуальные сложности в работе с системой, Оператор рекомендует обращаться к индивидуальным менеджерам и в службу технической поддержки.
Вы можете направить обращения по любому каналу:
— Через чат на сайте честныйзнак.рф. Чат расположен в правом нижнем углу экрана.
— Через чат в мобильном приложении Честный ЗНАК.Бизнес (скачать App Store и Google Play)
— По электронной почте support@crpt.ru или support@support.crpt.ru
— По телефонам: 8 800 222 1523 (для звонков из России), +7 499 350 85 59 (для звонков из других стран)
Ранее Центр развития перспективных технологий опубликовал рекомендации для бизнеса, они доступны на сайте «Честного знака»
Рекомендации Оператора-ЦРПТ для бизнеса в связи с DDoS-атаками
Минпромторг разъяснения по МДЛП
05.07.2021
Упрощённый порядок работы в системе маркировки и прослеживания лекарств в России продлевается ещё на 7 месяцев. Постановление об этом подписал Председатель Правительства Михаил Мишустин.

